全球首款,国内第一证!博尔诚食管癌基因甲基化检测试剂盒获批上市
2024-08-08 11:06 来源:光明健康 阅读量:13586 会员投稿 小 中
2024年8月7日,国家药品监督管理局(NMPA)官网公示,由博尔诚(北京)科技有限公司(以下简称“博尔诚”)自主研发的思博士? MT-1A、Epo及Septin9基因甲基化检测试剂盒(PCR荧光探针法)获批上市。该试剂盒是NMPA批准上市的首款食管癌血液基因甲基化检测产品。它的研发成功,标志着我国在食管癌早期检测领域取得重大突破,实现从“0”到“1”的跨越式创新,是引领食管癌检测跨入新时代的创新成果。

根据介绍,思博士?同时实现四大创新突破。不仅首次发掘出可用于食管癌检测的中国人群特异的三个甲基化标志物,填补国内国际空白,同时对比传统检测方式,思博士?对早期食管癌(0-I期)检测灵敏性提升5~10倍以上。此外,博尔诚还对检测样本的处理技术进行迭代升级,突破性实现5ml外周血的高效精准检测。搭配博尔诚自主研发的全自动甲基化核酸处理仪,实现了2.0mL血浆样本的全自动化处理,极大提升了样本处理效率。
“思博士?采用基于ctDNA(循环肿瘤DNA)的液体活检技术,通过测定外周血中肿瘤DNA特定位点(MT-1A、Epo及Septin9基因)的基因甲基化水平,从而对受检者是否患食管癌进行测定。”博尔诚研发中心负责人周光朋博士表示,在思博士?开发之前,全球范围内,尚没有有效的、经过临床验证的针对食管癌的基因甲基化标志物。博尔诚研发团队通过大量的全基因组甲基化测序以及生物信息学分析和实验验证等,首次从全基因组里挖掘出三个与食管癌密切相关、检测性能好、中国人群特异的标志物,填补国内国际空白。
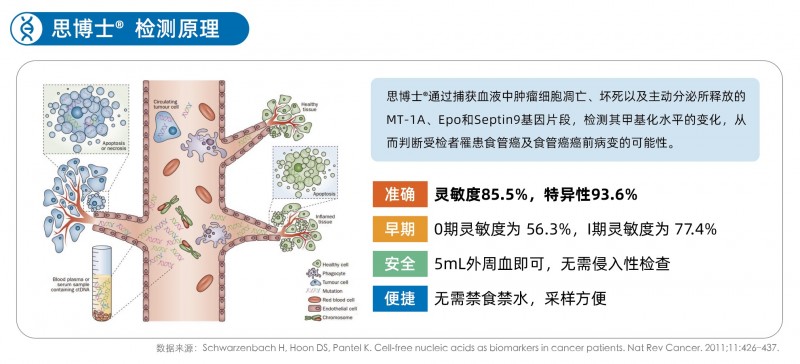
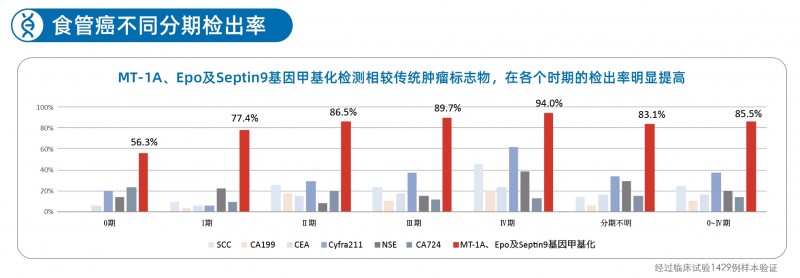
此外,灵敏度和特异性是评价IVD(体外诊断产品)性能的一个重要指标,思博士?的灵敏性可以达到85.5%,特异性93.6%,在行业具有突出优势。临床数据显示,思博士?对0期、I期、II期、III期、IV期食管癌的检测灵敏度均显著高于传统蛋白肿瘤标志物,特别是针对早期食管癌(0-I期),思博士?的检测性能对比传统肿瘤标志物,灵敏性提升5~10倍以上,具有十分突出的临床价值。
从“0”突破,博尔诚走的是“无人之径”,碰到了许多“拦路虎”。“标志物开发过程中,没有参考文献和资料,从头开始研发时间长,资金压力大,要想成功,除了企业自身的坚持,也与经开区优质的营商环境和产业生态托举密不可分。”周光朋博士说。
在充分发挥科技创新的优势下,不仅仅是思博士?,博尔诚还成功孕育了多项创新成果。NMPA官网显示,截至2024年7月,博尔诚已获批结直肠癌、胃癌、食管癌三款高发消化道癌症基因甲基化检测试剂盒,均为中国首款。其中,思博定?Septin9基因甲基化检测试剂盒(结直肠癌早诊)和思博卫?RNF180/Septin9基因甲基化检测试剂盒(胃癌早诊)获得了创新医疗器械文号,纳入多省市医保,已在全国超300家医院广泛落地应用,真实世界应用检测人数超过200万例,多个权威指南和专家共识推荐使用。
据悉,目前博尔诚还有一款肝癌早诊产品已经进入到临床试验阶段,不久后也将传出好消息,为患者提供更多诊疗选择。同时公司已完成尿路上皮癌、卵巢癌、宫颈癌、子宫内膜癌等癌症以及心脑血管、脑卒中等慢病早筛早诊的技术储备,接下来,博尔诚将以国家战略需要和国家政策为引领,以市场需求和患者为导向,以甲基化技术为核心,统筹布局更多前沿创新技术,开发相关的早发现、早诊断、早干预(“三早”)产品,让更多人远离重大疾病,切实提升人民群众健康生活质量。
郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。
相关文章
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06
- 2024-08-08 11:06


